学内講師 上野 盛夫 先生 研究
緑内障
上野 盛夫の主たる研究成果と抱負
胚性幹細胞(ES細胞)は胚盤胞期の胚の内部細胞塊より作成される、無限に増殖し、体中のあらゆる細胞に分化しうる能力を持った特殊な幹細胞です。マウスES細胞は1981年の樹立以来、それを使って遺伝子改変マウスの作製などの技術が確立され、マウスの遺伝学解析においては中心的な役割を担ってきました。1998年に米国のThomson教授らのグループがヒトES細胞を樹立して以来、再生医療における可能性を秘めることで、ES細胞を用いた分化研究がにわかに注目を集めるようになりました。2007年に山中教授らのグループによりヒトiPS細胞が樹立され、ヒトES細胞のもつ倫理的問題点が一挙に解決され、ヒト多能性幹細胞(ヒトES細胞やヒトiPS細胞など)研究は世界的な広がりをみせています。
私は平成14年より理化学研究所発生・再生科学総合研究センター(神戸市)にてマウス・サル・ヒト由来多能性幹細胞に従事してきました。私の主な研究テーマは「試験管内での多能性幹細胞を用いた真に臨床に使える神経および眼組織分化方法の開発」です。試験管内で多能性幹細胞から高効率に神経組織を分化誘導する方法としては、ドーパミン神経細胞を高効率に分化誘導するSDIA(Stromal cell Derived Inducing Activity)法が世界中で用いられています。SDIA法はPA6細胞という特殊なマウス由来のフィーダー細胞が産生する因子を用いて、多能性幹細胞からドーパミン神経細胞などの中枢神経系ニューロンを試験管内で高効率に分化させる方法です。SDIA法でサルES細胞から分化させたドーパミン神経細胞は、パーキンソン病モデルサルの大脳基底核に移植すると治療効果があることも実証され、SDIA法はES細胞の再生医学の応用に役立つ優れた方法論でした。しかし動物(マウス)由来のPA6細胞を培養中に分化誘導源として共存させる必要があり、それによる動物由来病原体の感染等のリスクが否定出来ないため、移植治療のための細胞をヒトES細胞から産生する臨床応用には問題がありました.そのため,私はこの障壁を解決しヒトES細胞の臨床応用を実現化するヒト由来材料を用いた新規培養方法の開発を行いました。
私が用いたヒト由来材料は妊娠期に胎児を包んでいる羊膜です。羊膜上にマウスES細胞を蒔き無血清培養液で培養すると、マウスES細胞は増殖してコロニーを形成し、90%以上の高い効率で神経前駆細胞を5日間以内に分化誘導しました。そこでこの羊膜を用いた新規の神経分化誘導法をAMED(Amniotic membrane Matrix-based ES cell Differentiation)法と名付け、そのAMED法をヒトES細胞の分化培養に応用したところ、ヒトES細胞からも90%程度の効率で神経前駆細胞を約2週間の培養で分化誘導することに成功しました。AMED法によりヒトES細胞を神経前駆細胞に分化させた後、さらに約4週間培養すると約4割の細胞が神経細胞に分化し、そのうち約3割の細胞がドーパミン神経細胞でした。この効率はマウス由来のPA6細胞を用いたSDIA法に匹敵する高い効率で、中間段階での細胞選別などを行わずに、直接ヒトES細胞から(動物由来の誘導源を用いずに)このように高い効率でドーパミン神経細胞の分化誘導に成功したことは世界初でした。分化培養の過程でソニック・ヘッジホグという運動神経細胞の分化を促進する可溶性タンパク質を添加することで、約2割の神経細胞を運動神経細胞に分化させることも可能でした。
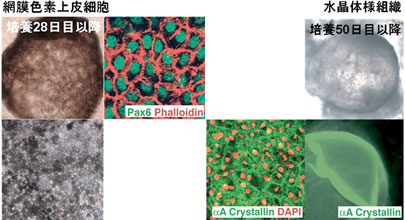
また,ヒトES細胞をドーパミン神経細胞に分化させる条件下で、AMED法によりヒトES細胞を長期培養すると眼組織である網膜色素上皮細胞および水晶体組織の大きな細胞塊が出現しました。図に示しますように、網膜色素上皮細胞はPax6いう遺伝子を発現した褐色の6角形の細胞であることより、水晶体組織はαAクリスタリンという水晶体に特異的な遺伝子を発現したきらきらと光る組織であることより、それぞれを確認しました。神経組織を作るのと同じ方法で眼組織ができることは眼(網膜)が終脳(大脳)の一部分であると考えると不思議ではありません。
今後は今まで主に行ってきたヒト多能性幹細胞研究からの神経分化誘導研究の経験を元に、臨床に直結するヒト多能性幹細胞を用いた眼組織の再生医療研究に取り組んでゆきたいと考えています。
1.Neural conversion of ES cells by an inductive activity on human amniotic membrane matrix.
Ueno M, Matsumura M, Watanabe K, Nakamura T, Osakada F, Takahashi M, Kawasaki H, Kinoshita S, Sasai Y.
Proc Natl Acad Sci U S A. 2006 103(25):9554-9.
2.A ROCK inhibitor permits survival of dissociated human embryonic stem cells.
Watanabe, K, Ueno, M, Kamiya, D, Nishiyama, A, Matsumura, M, Wataya, T, Takahashi, JB, Nishikawa, S, Nishikawa, S, Muguruma, K, Sasai, Y
Nat. Biotechnol. 2007 25(6):681-6
3.Pericellular matrix of decidua-derived mesenchymal cells: a potent human-derived
substrate for the maintenance culture of human ES cells.
Nagase T, Ueno M, Matsumura M, Muguruma K, Ohgushi M, Kondo N, Kanematsu D, Kanemura Y, Sasai Y.
Dev Dyn. 2009 May;238(5):1118-30.

